Dubbele lithiumzoutgel Complexe elektrolyt: bereiding en toepassing in lithiummetaalbeslagy
GUO Yuxiang, HUANG Liqiang, WANG Gang, WANG Hongzhi. Dual-lithium-zout-gelcomplex Elektrolyt: voorbereiding en toepassing in lithiummetaalbatterijen. Journaal van Anorganische materialen, 2023, 38(7): 785-792 DOI:10.15541/jim20220761
Samenvatting
Metallic Li is een van de ideale anodes voor lithium-ion met hoge energiedichtheid batterij vanwege de hoge theoretische specifieke capaciteit en het lage reductiepotentieel evenals overvloedige reserves. De toepassing van Li-anodes heeft echter last van ernstige onverenigbaarheid met traditionele organische vloeibare elektrolyt. Hierin is een gelcomplexelektrolyt (GCE) met bevredigende compatibiliteit met metallisch Li anode werd geconstrueerd via in situ polymerisatie. De dubbele Het lithiumzoutsysteem dat in de elektrolyt wordt geïntroduceerd, kan samenwerken met de polymeercomponent, die het elektrochemische venster van de elektrolyt verbreedt 5,26 V vergeleken met 3,92 V commerciële elektrolyt, en verkrijgt een hoog ionisch vermogen geleidbaarheid van 1Ã10-3 S·cm-1 ook bij 30 â. Resultaten van morfologiekarakterisering en elementaire analyse van Li-anode-oppervlakteshow dat GCE een duidelijk beschermend effect op lithiummetaal vertoont onder de toestand van dubbel lithiumzoutsysteem, en volume-effect en dendrietgroei van Li-anode worden duidelijk geremd. Tegelijkertijd is het lithiummetaal vol batterij, geassembleerd met commercieel lithiumijzerfosfaat (LiFePO4) kathodemateriaal, vertoont uitstekende fietsstabiliteit en snelheidsprestaties. De capaciteit het retentiepercentage van de batterij bereikt 92,95% na 200 cycli bij een constante snelheid stroom van 0,2C (1C = 0,67 mA·cm-2) bij 25 â. Dit onderzoek geeft aan dat de GCE de veiligheid, stabiliteit en alomvattendheid effectief kan verbeteren elektrochemische prestaties van een lithium-metaalbatterij, wat naar verwachting ook zal gebeuren een strategie bieden voor het ontwerpen van universele quasi-vaste elektrolyten.
Zoekwoordenï¼ metallic Li; in-situ polymerisatie; gelcomplex elektrolyt
Sinds het doel 'Double Carbon' werd gesteld China wordt in 2020 geconfronteerd met een ongekende hervorming van het energiesysteem. China moet de komende dertig jaar een diepgaande vermindering van de CO2-uitstoot voltooien, en groene energie zal geleidelijk aan sterker worden totdat deze het âmonopolieâ vervangt positie van traditionele fossiele energie. Als een belangrijk onderdeel van de hernieuwbare energie energiesysteem, lithium-ionbatterijtechnologie heeft wijdverspreid aangetrokken aandacht zodra het uitkwam. Op dit moment is het niet alleen de belangrijkste energiebron apparaat van 3C elektronische producten, de toepassing van lithiumbatterijen in de gebieden van de auto-industrie, ruimtevaart en smart grid geleidelijk aan toeneemt, wat hogere eisen stelt aan de prestaties ervan. In Om een groter vaarbereik te verkrijgen, zijn krachtige lithiumbatterijen nodig een batterijsysteem ontwikkelen met een hogere energiedichtheid. Onder hen lithiummetaal met ultrahoge specifieke capaciteit (3860 mAh g-1) en laag reductiepotentieel (-3,04 V (vs SHE)) zal naar verwachting het anodemateriaal voor de volgende generatie worden van batterijen met een hoge energiedichtheid. Wanneer lithiummetaal echter in contact komt bij organische vloeibare elektrolyten blijven nevenreacties optreden interface, wat leidt tot een oncontroleerbare groei van lithiumdendrieten, die de interne scheider van de batterij, waardoor kortsluiting en zelfs veiligheid ontstaat problemen. Als reactie op dit defect wordt meestal overwogen om vaste stof te gebruiken elektrolyt in plaats van vloeibare elektrolyt om de veiligheid van de batterij te verbeteren. Echter, de lage ionische geleidbaarheid bij kamertemperatuur en het slechte grensvlak compatibiliteit vormt een ernstige belemmering voor de verdere ontwikkeling en toepassing ervan.
Tegen deze achtergrond, gel-staat elektrolyten die grensvlakcontacten en ionische geleidbaarheid in evenwicht kunnen brengen hebben steeds meer aandacht gekregen. Tan Shuangjie et al. ontwikkelden een niet-ontvlambare elektrolyt in geltoestand door vlamvertrager te immobiliseren organofosfaten in een polymeermatrix van polyvinyleencarbonaat met hoge mechanische sterkte. De elektrolyt heeft de voordelen van een hoog ionisch karakter geleidbaarheid en lithium-ionenoverdrachtsnummer, niet-ontvlambaarheid, hoge mechanische sterkte en goede elektrochemische compatibiliteit. Daarnaast de gel elektrolyt gevormd in de batterij door in-situ polymerisatie heeft de kenmerken van lage viscositeit, gemakkelijke bediening en sterk bevochtigingsvermogen, die de actieve materialen volledig kunnen infiltreren en een ideaal grensvlak kunnen produceren contact, waardoor een goed ionenmigratiepad wordt verkregen. Bijvoorbeeld die van Guo Yuguo onderzoeksgroep mengde het traditionele op ether gebaseerde monomeer 1,3-dioxolaan (1,3-dioxolaan, DOL) met 1,2-dimethoxyethaan (1,2-dimethoxyethaan, DME), commercieel lithium Hexafluorfosfaat (LiPF6) kan als lithiumzout de ringopening activeren tegelijkertijd polymerisatie van DOL, en een nieuwe elektrolyt in geltoestand kan stabiel werken in lithium-zwavelbatterijen en commerciële kathodebatterijen is verkregen. Hoewel op polyether gebaseerde polymeer een van de meest stabiele is elektrolyten voor lithiummetaalanodes, het smalle elektrochemische venster en lage ionische geleidbaarheid bij kamertemperatuur beperkt de toepassing ervan bij hoge energie dichtheid batterijen. Hoewel LiPF6 een ideale ionische geleidbaarheid heeft en uitstekend is elektrodecompatibiliteit heeft het probleem van slechte elektrochemische stabiliteit. Daarom moet een gel-staat elektrolyt met een uitstekende alomvattende ontwikkeling worden ontwikkeld prestatie is het noodzakelijk geschikte polymeergastheren, lithiumzouten, te selecteren en andere componenten.
Om de relatie tussen elkaar in evenwicht te brengen geleidbaarheid, hoogspanningsstabiliteit en elektrodecompatibiliteit, a In deze studie werd een vast-vloeistofcomposiet met hoge prestaties GCE ontwikkeld. De Er werd gebruik gemaakt van een thermisch geïnitieerde in-situ polymerisatiemethode, PEGDA werd gebruikt als monomeer was er een gemengd oplosmiddel van ethyleencarbonaat en diethylcarbonaat toegevoegd, en LiTFSI en LiDFOB werden geïntroduceerd als het dubbele lithiumzoutsysteem om samen te werken met de polymeercomponenten. Terwijl het verbeteren van de elektrochemische prestaties, de stabiliteit van het grensvlak tussen de elektrolyt en de lithiummetaalanode is verder verbeterd.
1 Experimentele methode
1.1 Voorbereiding van GCE
LiTFSI, LiDFOB, EC en DEC (Suzhou Duoduo Chemical Technology Co., Ltd.) zijn allemaal batterijmaterialen van watervrije kwaliteit. De EC- en DEC-reagentia werden gemengd en LiTFSI en LiDFOB werden gewogen en opgelost in het oplosmiddel. De bereide elektrolyt met dubbel zoutsysteem (Liquid Electrolyt, LE) was een EC/DEC (volumeverhouding 1:1) oplossing van 1 mol/L LiTFSI en 0,2 mol/l LiDFOB. PEGDA (â¥99%, Mn=400) en azobisisobutyronitril (Azodiisobutyronitril, AIBN, 98%) werden gekocht bij Shanghai Aladdin Reagent Co., Ltd. De precursoroplossing van GCE werd bereid door PEGDA en LE te mengen, en de massafractie van PEGDA was 10%, 20% en 30%. Voeg 1% massafractie toe thermische initiator AIBN en roer goed. De PEGDA-voorloperoplossing werd verwarmd bij 70 °C gedurende 2 uur om volledig gepolymeriseerd op PEGDA gebaseerd gelcomposiet te verkrijgen elektrolyten, die GCE-x werden genoemd (x=10, 20, 30). De bovenstaande experimenten waren alles uitgevoerd in een watervrije en zuurstofvrije handschoenenkast.
1.2 Montage van de batterij
Batterijsamenstel van CR2025-knoopcel (316 roestvrij staal, RVS), lithiummetaalplaat (14 mmÃ0,45 mm, Li), aluminiumfolie (batterijkwaliteit). Volgens verschillende testvereisten, SS||SS-batterijen, Li||SS-batterijen, Li||Li-batterijen en Li||LiFePO4-batterijen werden erin gemonteerd het handschoenenkastje. De massaverhouding van LiFePO4, Ketjen Black en Polyvinylideen Difluoride (PVDF) in het kathodemateriaal is 90: 5: 5, en de oppervlaktecapaciteit bedraagt 0,67 mAh·cm-2. Zie aanvullend materiaal S1 voor details over de voorbereiding proces van de positieve elektrodeplaat en het assemblageproces van de batterij.
1.3 Karakteriseringsmethoden van materialen
De functionele groepen en chemische structuren van PEGDA-monomeren en hun polymeren werden geanalyseerd met behulp van een Thermo NiColet iS50 Fourier Transform Infraroodspectrometer (Fourier Transform Infraroodspectrometer, FT-IR) van Thermo Fisher Scientific Corporation uit de Verenigde Staten, met een golflengtebereik van 400-4000 cm-1. De kristalliniteit van de elektrolyten in geltoestand met verschillende polymeergehalten werden gekenmerkt door een D2 Phaser röntgendiffractometer (X-Ray Diffractometer, XRD) van Bruker AXS Company, Duitsland, en het scanbereik was 2θ=5°~80°. Het OCA40Micro-contact hoekmeetinstrument van Beijing Dongfang Defei Instrument Co., Ltd. was gebruikt om de contacthoek van precursoroplossingen met verschillende PEGDA te testen inhoud op het oppervlak van LiFePO4-elektrodeplaat. De microscopische morfologie van de dwarsdoorsnede en het oppervlak van de lithiummetaalplaat werd waargenomen door a JEelectronics JSM-7500F veldemissie-scanning-elektronenmicroscoop (Field Emissie-scannende elektronenmicroscoop, FESEM). De elementaire informatie over de Het oppervlak van de lithiummetaalplaat werd geanalyseerd met behulp van een Escalab 250Xi röntgenfoto foto-elektronenspectrometer (röntgenfoto-elektronenspectroscopie, XPS) van Thermo Fisher Scientific Corporation uit de Verenigde Staten.
1.4 Elektrochemische test
Het elektrochemische stabiliteitsvenster van de elektrolyt werd getest met lineaire sweep-voltammetrie (LSV), het spanningsbereik was van nullastspanning (OCV) tot 6 V, en de sweepsnelheid was 1 mV·s-1. De frequentiebereik van elektrochemische impedantiespectroscopie (EIS) is 10-2 ~ 106 Hz, en de verstoringsspanning is 10 mV. Om te meten werd chronoamperometrie gebruikt het migratiegetal van lithiumionen in de elektrolyt, het potentieel het verschil werd ingesteld op 10 mV, en de tijd was 800 s, en het migratienummer lithiumionen werd verkregen volgens formule (1):
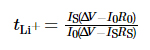
Daarvan is tLi+ het overdrachtsnummer van lithiumionen, ÎV is het potentiaalverschil, R0 en RS zijn de interface impedantiewaarden van de elektrode en elektrolyt voor en na de test, respectievelijk, en I0 en IS zijn de huidige en stabiele begintoestand respectievelijk actueel. Bovenstaande tests zijn allemaal uitgevoerd op de PARSTAT MC meerkanaals elektrochemisch werkstation van AMETEK, VS. De laad-ontlaadcyclusprestaties van de batterij is getest met behulp van het LAND CT3001A-1U batterijtestplatform van Wuhan Landian Electronics Co., Ltd.
2 Resultaten en discussie
2.1 Voorbereiding en structurele analyse van GCE
In deze studie werd PEGDA gebruikt als monomeer, AIBN werd gebruikt als polymerisatie-initiator en EC en DEC werden geïntroduceerd als weekmakers. Een elektrolyt in geltoestand met een verknoopt polymeer polyethyleenglycoldimethacrylaat (p(PEGDA)) werd gesynthetiseerd bij 70 ºC. De De polymerisatiereactieformule wordt getoond in Figuur 1(a). Na het toevoegen van de thermische initiator AIBN, PEGDA met twee actieve terminale C=C-groepen snel ondergaat intermoleculaire homopolymerisatie bij verhitting tot 70 °C. De actieve ketens van AIBN zorgen ervoor dat de moleculaire ketens met elkaar of intern verbinden, en uiteindelijk de skeletstructuur van het p(PEGDA)-netwerk verkrijgen, en met succes gebruik de in-situ polymerisatiemethode om de elektrolyt in de geltoestand te verkrijgen in de batterij. Zoals weergegeven in figuur S1, zijn de drie precursoroplossingen met verschillende PEGDA-gehalten vertoonden allemaal een goede bevochtigbaarheid op het LiFePO4-positief elektrodevel, wat de sleutel is om een goed grensvlakcontact tussen de twee te verkrijgen de elektrolyt en de elektrode.
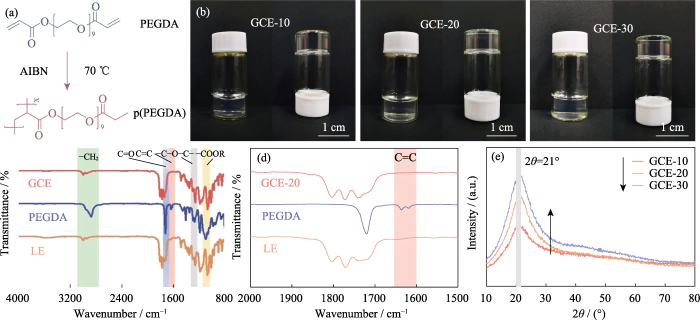
Afb. 1 Voorbereiding en structurele analyse van GCE
(a) Polymerisatie reactie van PEGDA; (b) Optische foto's van GCE-x; (c, d) FT-IR spectra van GCE-20, PEGDA en LE; (e) XRD-patronen van GCE-x; Kleurrijk cijfers zijn beschikbaar op website
Om GCE met hoge ionen te verkrijgen geleidbaarheid, LiTFSI, dat een hoge mate van dissociatie in het polymeer heeft, werd gebruikt als het lithiumzout en er werd 0,2 mol/l LiDFOB geïntroduceerd om te construeren het gelnetwerk van het dubbelzoutsysteem. LiDFOB heeft een goede oplosbaarheid en thermische stabiliteit, vooral wat betreft filmvormende eigenschappen. Wanneer carbonaat oplosmiddelen komen in contact met lithiummetaalanodes, een groot aantal losse Er zullen waarschijnlijk poreuze of dendritische lithiumafzettingslagen worden gevormd oppervlak van lithiummetaal. De introductie van LiDFOB kan hierbij helpen vorming van HF-vrije vaste elektrolyt-interfase (Solid Electrolyte Interphase, SEI)-laag en verbetert de compatibiliteit met lithiummetaalanodes. Tegelijkertijd heeft LiTFSI een corrosief effect op metalen stroomcollectoren, terwijl LiDFOB aluminiummetaal kanpassiveren en het corrosie-effect ervan kan verminderen LiTFSI op stroomafnemers. Echter, de single-zoutelektrolyt van LiDFOB vertoonde een hogere impedantie dan de LiTFSI-LiDFOB dual-zoutelektrolyt van de dezelfde concentratie. Zoals weergegeven in afbeelding S2 was de Li||LiFePO4-batterij dat wel geassembleerd met behulp van 1,2 mol / l LiDFOB- en LiTFSI-LiDFOB-gelelektrolyten, respectievelijk, en de impedantie van de LiTFSI-LiDFOB-batterij was aanzienlijk kleiner.
Uit bestaande onderzoeksresultaten blijkt dat LiTFSI en LiDFOB kunnen een synergetisch effect hebben, waardoor de compatibiliteit van de elektrolyt met de lithiummetaalanode. Jiao Shuhong et al. gebruikte XPS en FT-IR om te ontdekken dat de dubbelzoutelektrolyt van LiTFSI en LiDFOB kan de aluminium stroomcollector van de positieve elektrode passief maken en vormen een stabiele SEI-laag op het oppervlak van het lithiummetaalnegatief elektrode om een stabiele cyclus van lithium-metaalbatterijen op lange termijn te bereiken. Op deze basis, Liu Yue et al. [26] maakte gebruik van hybride moleculaire dynamica-simulatie het gezamenlijke werkingsmechanisme van LiTFSI en LiDFOB in lithiummetaal bestuderen batterijen, en legde het beschermende effect van LiTFSI op LiDFOB uit. Studies hebben aangetoond dat de B-O-binding van LiDFOB relatief de zwakste is en daar gevoelig voor is breuk. LiDFOB zal snel ontleden onder invloed van vrije radicalen reageren met lithiummetaal om vrije Li0- en booratomen te produceren. Het booratoom De insertiereactie zorgt ervoor dat de oplosmiddelmoleculen in de elektrolyt zich vormen ontleden, en de resulterende moleculaire fragmenten zullen ermee blijven reageren moleculaire fragmenten van lithiumzout en booratomen. In het dilithiumzoutsysteem LiTFSI valt echter bij voorkeur uiteen, afhankelijk van het "opoffering". mechanisme" om LiDFOB te beschermen, is de ontbindingssnelheid van LiDFOB aanzienlijk verminderd. Daardoor wordt het aantal vrije Li0- en booratomen verminderd, die de SEI-laag kan optimaliseren en de lithiummetaalanode kan beschermen.
Zoals weergegeven in figuur 1(b) is GCE-x uniform en transparant geleiachtig, niet langer vloeibaar. Om monomeer verder te verifiëren polymerisatie werd FT-IR gebruikt om de chemische structuren van LE te karakteriseren, PEGDA-monomeer en GCE-20. Zoals getoond in figuur 1(c), tonen alle drie de monsters de typische absorptiepiek van C=O-strekvibratie (~1726 cm-1). De absorptiepiek bij 1280 cm-1 van GCE komt overeen met de antisymmetrische en symmetrische rekpieken van de etherbinding, wat aangeeft dat -(CH2CH2)n-in het monomeer wordt tijdens de polymerisatie niet vernietigd. De pieken bij 1095 en 2867 cmâ1 behoren respectievelijk tot -COOR en -CH2. Als getoond in Figuur 1(d), is de karakteristieke piek van de C=C-binding van PEGDA gelokaliseerd op 1616-1636 cm-1, maar verdwijnt in GCE, wat aangeeft dat PEGDA volledig gepolymeriseerd.
Omdat lithiumionen alleen in de lucht migreren amorf gebied van GCE, waardoor de kristalliniteit van de elektrolyt wordt verminderd gunstig om de ionische geleidbaarheid te verbeteren. Figuur 1(e) is het XRD-patroon van GCE-x. De drie soorten monsters hebben allemaal een unieke diffractie-absorptiepiek bij 2θ=21°, wat aangeeft dat de bereide elektrolyt een amorf gebied heeft vergezeld van een kleine hoeveelheid kristallieten. Zoals de inhoud van PEGDA toeneemt, neemt het piekgebied van het spectrum aanzienlijk toe, de Het aandeel van het amorfe gebied van de gel-elektrolyt neemt af, en de het gehalte aan amorfe componenten in de elektrolyt neemt af, wat niet het geval is bevorderlijk voor ionenmigratie.
2.2 Elektrochemische prestaties van GCE en Compatibiliteitsanalyse van Li-metalen
Om de compatibiliteit van te bestuderen elektrolyten met verschillende polymeergehalten met lithiummetaalanodes erin batterijen, de impedantiespectra van Li||Li symmetrische batterijen met GCE-x elektrolyten in de begintoestand werden geanalyseerd (zoals weergegeven in Figuur S3). In de In de afbeelding zijn de interface-impedantiewaarden van de GCE-10- en GCE-20-batterijen dat wel beide klein, respectievelijk 93 en 152 Ω, en de GCE-30-batterij bereikt 409 Ω. Het laat zien dat de migratie van lithiumionen in GCE met een hoger polymeergehalte vereist is om een grotere migratiebarrière te overwinnen, wat niet bevorderlijk is voor de snelle migratie geleiding van lithiumionen aan het grensvlak.
Het overpotentieel van de Li||Li observeren symmetrische batterij in de laad-ontlaadcyclustest, kunnen we het potentieel kennen verschil gegenereerd door de migratie van ionenparen tijdens dit proces, en vervolgens evalueer het lithiumafzettings-/stripgedrag. Figuur S4 toont de spanning-tijdcurven van de Li||Li symmetrische cel van GCE-x. De testtemperatuur was 25 â, en de batterij werd onder een constante stroom opgeladen en ontladen met een specifieke capaciteit van 0,5 mAh cm-2 en een stroomdichtheid van 0,5 mA cm-2. De initiële overpotentiaal van Li|GCE-10|Li-cellen was 22 mV, en de spanning verhoogd tot 137 mV na 250 uur. Het overpotentiaal van de GCE-30 is symmetrisch batterij was in de beginfase 104 mV en het overpotentiaal liep snel op de daaropvolgende cycli, waarbij een piekwaarde van 509 mV werd bereikt in 227 uur en daarna daalde scherp, wat aangeeft dat de batterij een interne kortsluiting had. In Daarentegen kan de GCE-20-batterij werken met een laag overpotentiaal van bijna 30 mV, en heeft de meest stabiele elektrochemische prestaties. Het volgende zal zich richten op de GCE-20-elektrolyt.
De ionische geleidbaarheid van een elektrolyt weerspiegelt rechtstreeks het vermogen van ionen om in een elektrisch veld te migreren. De ionische geleidbaarheid van LE en GCE-20 werd getest op 60, 50, 40, 30, 20, 10 en 0 , respectievelijk. Zoals weergegeven in figuur 2(a), is de ionische geleidbaarheid van GCE-20 bij 30 °C is 1,00 mS cm-1, en wanneer de testtemperatuur stijgt tot 60 °C, wordt de geleidbaarheid bereikt 1,39 mS cm-1. Dit komt door de activeringsenergie neemt af met de toename van de testtemperatuur en de bewegingsactiviteit van polymeerketensegmenten en lithiumionen nemen toe. Echter, de bewegingssnelheid van polymeerketensegmenten wordt duidelijk beïnvloed door de temperatuur, dus de De geleidbaarheid van GCE-20 gel-elektrolyt verandert meer dan die van elektrolyt oplossing.
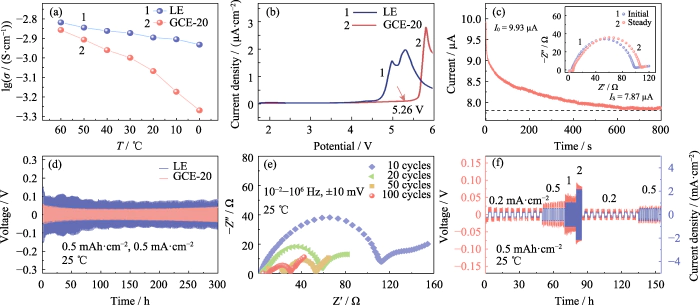
Afb. 2 Elektrochemische prestaties van GCE-20
(a) Ionisch geleidbaarheid van LE en GCE-20; (b) LSV-curven van LE en GCE-20; (C) Huidig-tijdprofiel van Li|GCE-20|Li-cel met overeenkomstige inzet Nyquist-percelen; (d) Spanning-tijdcurven van symmetrische Li||Li-cellen geassembleerd met LE en GCE-20; (e) Nyquist-grafieken van Li | GCE-20 | Li-cel na fietsen; (F) Spanning-tijd- en stroomdichtheid-tijd-curven van Li|GCE-20|Li-cel; Kleurrijk cijfers zijn beschikbaar op website
Verbetering van de energiedichtheid van batterijen vereist het garanderen van de stabiliteit van de elektrolyt bij hoge bedrijfsspanningen. Studies hebben aangetoond dat op carbonyl gecoördineerde elektrolyten op basis van polymeren gewoonlijk voorkomen hebben een breed elektrochemisch venster en goede stabiliteit bij hoge bedrijfstemperaturen spanningen. Figuur 2(b) laat zien dat de LSV-curve van de GCE-20-batterij begint te lopen aanzienlijk fluctueren bij 5,26 V, en er kan van worden uitgegaan dat de het elektrochemische venster van de GCE-20-gelelektrolyt bereikt 5,26 V. In Daarentegen is het elektrochemische venster van de commerciële elektrolyt slechts 3,92 V. Daarom heeft de elektrolyt in geltoestand een uitstekende elektrochemische stabiliteit bij hoge spanning.
Daarnaast de migratie van lithiumionen nummer van de elektrolyt is ook een van de indicatoren om het lithium te meten ionengeleiding. Het wordt gedefinieerd als de verhouding van het aantal lithiumionen door een gedeelte van de elektrolyt loodrecht op de richting van migratie van lithiumionen per tijdseenheid tot de som van passerende anionen en kationen via de sectie. Hoe hoger de waarde, hoe groter het aandeel lithium ionen in het ionenmigratieproces, en hoe hoger de migratie-efficiëntie. Figuur 2(c) is de chronoamperometriecurve van de Li|GCE-20|Li-batterij, waarbij de inzet is de vergelijking van de elektrochemische impedantie van de batterij voor en na de proef. Volgens formule (1), het migratiegetal van lithiumionen van GCE-20 is 0,21. De introductie van additieven of doping met anorganische stoffen vulstoffen kunnen een hogere migratiesnelheid van lithiumionen verkrijgen, en dat is niet alleen het geval gunstig om de laad- en ontlaadsnelheid van de batterij te verbeteren, maar ook verbeter de cyclusstabiliteit.
Tijdens het laad- en ontlaadproces van Li||Li symmetrische batterij ondergaan de anionen en kationen in de elektrolyt contra-migratie. Tijdens het opladen migreren lithiumionen naar het negatieve elektrode, en anionen migreren naar de positieve elektrode, en het tegenovergestelde is klopt bij het ontladen. Daarom moet tijdens het laad- en ontlaadproces de ionenconcentratiegradiënt tussen de positieve en negatieve elektroden en het ingebouwde elektrische veld neemt geleidelijk toe, waardoor de tegenovergestelde beweging wordt belemmerd van anionen en kationen, wat resulteert in concentratiepolarisatie binnenin batterij, wat resulteert in een verandering in het overpotentiaal. Zoals weergegeven in figuur 2(d), is de Li|GCE-20|Li-batterij heeft een overpotentiaal van 46 mV na een stabiele cyclus gedurende 300 minuten H. Echter, de overpotentiaal gegenereerd door de Li|LE|Li accu tijdens de test is aanzienlijk hoger dan die van de Li|GCE-20|Li-batterij (65~118 mV). Dit komt doordat de groeiende lithiumdendrieten soms zachte kortsluiting veroorzaken interne sites. De resultaten laten zien dat het elektrochemische gedrag in de GCE-20-batterij is idealer. Figuur 2(e) is de EIS-test van de symmetrische batterij na 10, 20, 50 en 100 cycli. Als het aantal lading-ontlading cycli toenemen, neigt de batterij-impedantie af te nemen. Tijdens dit proces er werd een stabiele SEI-laag opgebouwd tussen de elektrolyt en het lithiummetaal interface, en het interfacecontact is geoptimaliseerd, zodat de interface de impedantie nam aanzienlijk af.
Bij 25 â was de Li|GCE-20|Li-batterij onderworpen aan 10 laad-ontlaadcycli bij stroomdichtheden van 0,2, 0,5, 1, 2, respectievelijk 0,2 en 0,5 mA cm-2. Figuur 2(f) weerspiegelt de trend van de overpotentiaal van de symmetrische cel in de loop van de tijd tijdens dit proces. De overpotentiaal bij lage stroomdichtheid is klein en kan relatief stabiel blijven. Nadat de stroomdichtheid toeneemt, neemt de overpotentiaal dienovereenkomstig toe, en er is geen plotselinge stijging/daling van de spanning tijdens het proces.
De morfologie van de lithiumplaatcoating na het fietsen kan het afzettings-/stripgedrag van visueel worden gekarakteriseerd lithium in de batterij. De Li||Li symmetrische batterij werd daarna gedemonteerd opladen en ontladen gedurende 100 uur bij een capaciteit van 0,5 mAh cm-2 en een stroomsterkte dichtheid van 0,5 mA cm-2, en de microscopische morfologie van de dwarsdoorsnede en oppervlak van de lithiummetaalplaat werd waargenomen door FESEM. Zoals weergegeven in figuur 3(a, b), de dikte van de onbehandelde, ongerepte lithiumplaat is 353 µm, en het oppervlak is vlak en glad. De interactie tussen de vloeibare elektrolyt en lithiummetaal leidt tot de afzetting van een groot aantal losse en poreuze materialen lithiumafzettingslagen op het oppervlak van de lithiumplaat van de Li|LE|Li batterij, meestal in de vorm van fijn en oneffen mos. Wanneer de dikte van de lithiummetaalplaat toeneemt tot 446 µm, is er een duidelijke volume-uitbreiding effect, en er wordt een groot aantal dendrieten gegenereerd. Daarentegen is de dikte van de lithiumplaat in de Li|GCE-20|Li batterij is 391 µm, en de De oppervlakteafzettingslaag is dicht en uniform en er is geen fijn verdeelde laag lithiumcoating (Fig. 3 (c)). Het laat zien dat de elektrolyt in geltoestand dat wel kan onderdruk effectief de volume-uitbreiding van de lithiummetaalanode. LiDFOB-in GCE-20 kan helpen bij de vorming van een stabiele SEI-laag om de interne balans in evenwicht te brengen potentieel van de batterij, en vertraag de groei van lithiumdendrieten door te induceren uniforme afzetting van lithium. Daarom kan het tot op zekere hoogte optimaliseren het lithiumafzettings-/stripgedrag en bescherm de lithiummetaalanode.

Afb. 3 SEM-afbeeldingen van metallisch Li
Dwarsdoorsnede (omhoog) en bovenaanzicht (naar beneden) SEM-afbeeldingen van (a) verse metallische Li- en lithiumafzetting morfologie in symmetrische Li||Li-cellen met (b) LE en (c) GCE-20
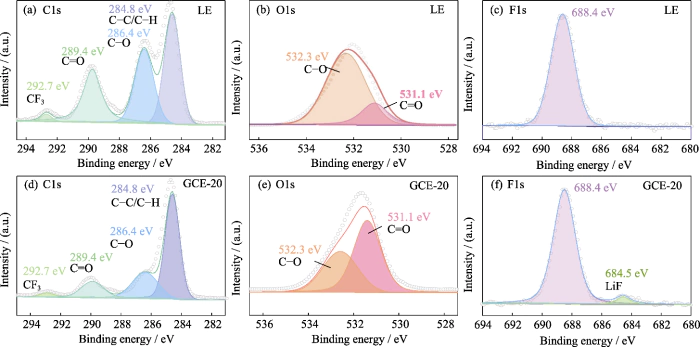
Vervolgens XPS-oppervlakte-elementenanalyse werd gebruikt om de samenstelling van de SEI-laag op het oppervlak van het oppervlak te onderzoeken lithiummetaalanode onder invloed van het LiTFSI-LiDFOB dubbelzoutsysteem GCE. Figuur S5 is het XPS-spectrum van het lithiummetaalanode-oppervlak met behulp van LE en GCE-20. Het spectrum van C1's (Fig. S5 (a, d)) heeft hoofdzakelijk 4 signaalpieken, overeenkomend met C-C/C-H bij 284,8 eV. De twee pieken bij 286,4 en 289,4 eV komen respectievelijk overeen met C-O en C=O, en zijn voornamelijk afgeleid van de afbraakproducten van carbonaatoplosmiddelen (zoals ROCO2-, ROC-, enz.). De piek bij 292,7 eV komt overeen met CF3, dat voornamelijk is afgeleid van de afbraakproducten van lithiumzouten. In het O1s-spectrum (Figuur S5 (b, e)), de pieken bij 531,1 en 532,3 eV komen respectievelijk overeen met C=O en C-O, en het relatieve gehalte aan C-O is aanzienlijk verminderd, wat voornamelijk gerelateerd is tot de afname van het gehalte aan afbraakproducten. Onder het gewricht actie van LiTFSI en LiDFOB, de vorming van LiOCH3, Li2O2C2H4 en andere bijproducten is beperkt. Voeg toein tegenstelling tot LE (Fig. S5(e)) in de F1's spectrum van GCE-20 (Fig. S5 (f)), de signaalpiek van LiF bedraagt 684,5 eV, en LiF kan helpen bij de vorming van een dichte en stabiele SEI-laag.
2.3 Elektrochemische prestatieanalyse van Li||LiFePO4-batterij
LiFePO4 heeft de voordelen van hoge capaciteit, lange levensduur en uitstekende veiligheid, en is een algemeen positief punt elektrode actief materiaal. De theoretische specifieke capaciteit bedraagt 170 mAh·g-1. Bij 25 â werd de Li|GCE-20|LiFePO4-batterij 200 keer opgeladen en ontladen in een mum van tijd constante stroom van 0,2C (1C=0,67 mA·cm-2). Zoals weergegeven in figuur 4(a, b), is de de ontladingsspecifieke capaciteit van de eerste cyclus is 141,4 mAh·g-1. De ontlading de specifieke capaciteit van de 200e ronde is 131,4 mAh · g-1, het capaciteitsbehoud het tarief bereikt 92,95% en het capaciteitsverval bij één draai is minder dan 0,04%. De platformspanning is stabiel, in lijn met de kenmerken van LiFePO4 batterijen. Coulombische efficiëntie, als belangrijke indicator voor het evalueren van de batterij cyclusstabiliteit, verwijst naar de verhouding tussen het ontlaadvermogen van de batterij en het opladen capaciteit tijdens dezelfde cyclus. De coulombische efficiëntie van de eerste cyclus van de Li|GCE-20|LiFePO4-batterij is 97,8%. Door de vorming van de SEI-laag tijdens het ontladingsproces van de eerste cyclus wordt een deel van de onomkeerbare capaciteit bereikt gegenereerd, wat resulteert in een lage coulombische efficiëntie in de eerste cyclus.
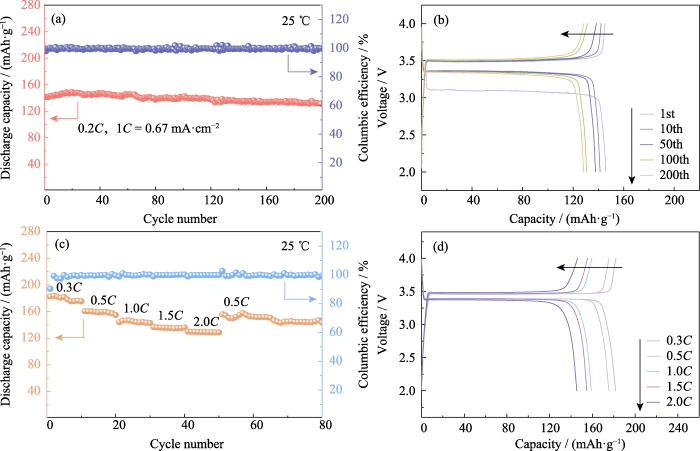
Afb. 4 Elektrochemische prestaties van de Li|GCE-20|LiFePO4 cellen
(a) Fietsen prestatie en (b) overeenkomstige spanningscapaciteitscurven bij 0,2 °C; (C) Beoordeelprestaties en (d) overeenkomstige spanningscapaciteitscurven; Kleurrijk cijfers zijn beschikbaar op website
Daarnaast laad- en ontlaadtests werden uitgevoerd op Li|GCE-20|LiFePO4 bij 0,3 °C, 0,5 °C, 1 °C, 1,5 °C en 0,5 °C stromingen om de koersprestaties ervan te onderzoeken. Zoals getoond in figuur 4(c), wanneer de huidige tarief is 0.5C, de eerste cyclus ontlading specifieke capaciteit van de batterij is 160,2 mAh·g-1. Naarmate het huidige tarief toeneemt, wordt de lozing specifiek De capaciteit van de batterij neemt binnen een controleerbaar bereik af. Het tarief is verhoogd tot 2C, en de specifieke capaciteit van de eerste cyclus dDe kosten bedragen 130 mAh·g-1. Vervolgens keerde de huidige rente weer terug naar 0,5 graden Celsius de specifieke capaciteit van de eerste ontladingscyclus was 156,1 mAh·g-1. De relevante spanningscapaciteitscurven worden getoond in figuur 4 (d). De plateauspanning bij verschillende tarieven stabiel zijn zonder een toename van het overpotentiaal te veroorzaken, en de batterij vertoont goede snelheidsprestaties en omkeerbaarheid.
3 Conclusie
Op PEGDA gebaseerde GCE is thermisch ontwikkeld het initiëren van in-situ polymerisatie. De FT-IR- en XRD-karakteriseringsanalyse van GCE, gecombineerd met elektrochemische tests, selecteerde de optimale GCE formulering. Monteer de batterij verder om de elektrochemische stof te bestuderen prestaties van de elektrolyt, en analyseer het beschermende effect van de elektrolyt op de negatieve lithiummetaalelektrode door de microscopische morfologie en karakterisering van oppervlakte-elementen van lithiummetaal, uitleggend:
1) De GCE-x (x=10, 20, 30) opgesteld door in-situ polymerisatie kan de elektrodeplaat en de elektrolyt goed bevochtigen heeft de beste elektrochemische stabiliteit wanneer de massafractie van PEGDA 20% bedraagt.
2) Het dilithiumzoutsysteem van LiTFSI en Er wordt LiDFOB geïntroduceerd, dat een goede interactie met het polymeer kan vormen componenten. De elektrolyt heeft een breed elektrochemisch venster (5,26 V) en hoog ionische geleidbaarheid (30 â, 1Ã10-3 S·cm-1). Tegelijkertijd het dilithiumzout systeem kan worden gebruikt om een stabiele SEI-laag te construeren en de lithiummetaalanode.
3) GCE-20 gebruiken om bij de commercial te passen LiFePO4-kathodemateriaal, de geassembleerde volledige batterij kan stabiel worden opgeladen en ontlading gedurende 200 cycli bij een stroomsterkte van 0,2C, met een capaciteitsbehoud van 92,95% en vertoont goede prestaties.
Samenvattend kreeg dit werk een veilige en uitstekende elektrochemische prestaties van GCE, wat zorgt voor een effectieve oplossing voor de ontwikkeling van veilig en stabiel lithium met hoge energiedichtheid metalen batterijen.
Extra materiaal:
S1-batterijvoorbereidingsproces
Meng en maal LiFePO4, Ketjen Black en PVDF voeg, afhankelijk van de doelverhouding, het oplosmiddel N-Methylpyrrolidon toe (N-Methylpyrrolidon, NMP), roer en dispergeer volledig en verkrijg een uniforme en viskeuze actieve materiaalslurry. De slurry werd met een schraaplaag op het aluminium aangebracht folie met een flatcoater, vervolgens overgebracht naar een vacuümoven en gedroogd bij 80 °C voor 12 uur. Nadat u het elektrodevel hebt afgesneden, droogt u het opnieuw en brengt u het over naar een watervrij en zuurstofvrij handschoenenkastje.
Een pakking, granaatscherven en lithiummetaalplaat werden achtereenvolgens in het midden van de negatieve elektrodebehuizing geplaatst, en de De dikte van de lithiummetaalplaat was 0,35 mm. Vervolgens de voorloper oplossing van GCE werd druppelsgewijs toegevoegd aan het midden van het oppervlak van het negatief elektrode (50 µl) met behulp van een pipetpistool, en vervolgens de Celgard 2500-batterij separator en de positieve elektrodeplaat (Celgard 2500 batterijscheider) werden op volgorde geplaatst. Voordat u de Li||LiFePO4-batterij monteert, moet u eerst de Het positieve poolstuk werd gewogen en de actieve materiaalbelasting werd geregistreerd. De actieve materiaaloppervlaktebelasting van de LiFePO4 positieve elektrode was 3,94 mg cm-2. Breng ten slotte de batterij onder druk en sluit deze af op een batterijsluitmachine. breng het over naar een omgeving van 70 °C en verwarm het gedurende 2 uur om te starten polymerisatie om een elektrolyt in geltoestand te verkrijgen. Om ervoor te zorgen dat de elektrolyt volledig in het LiFePO4-poolstuk infiltreert, moet de batterij zijn na montage 1 uur laten staan.
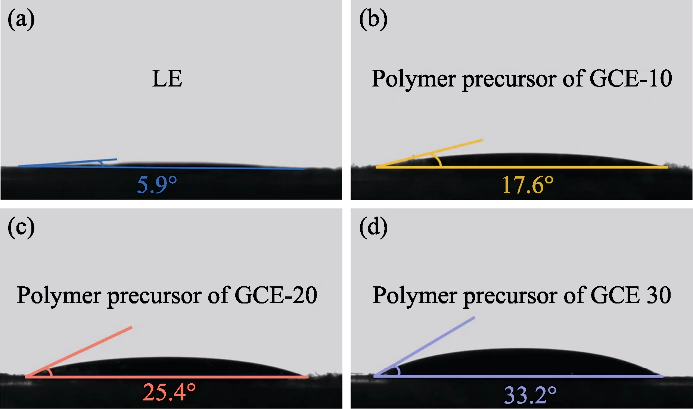
Fig. S1 Contacthoeken tussen polymeerprecursoroplossing en kathodes
(a) LE; (b) GCE-10; (c) GCE-20; (d) GCE-30
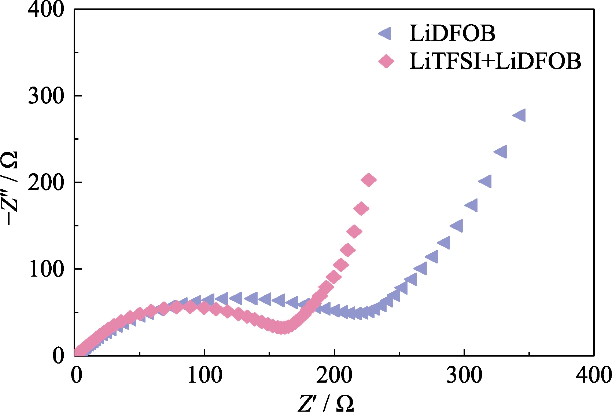
Afb. S2 Nyquist-plots van GCE-geassembleerde Li||LiFePO4-cellen met verschillende lithiumzouten
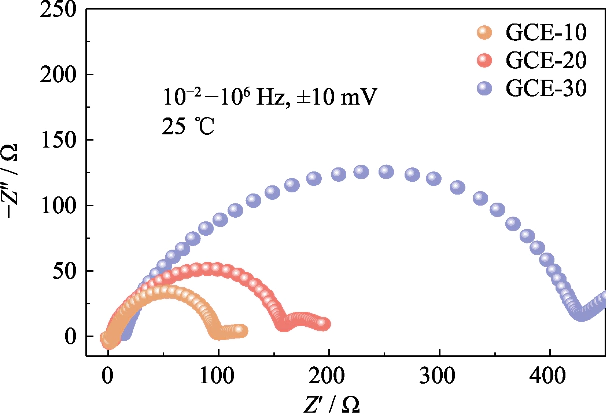
Afb. S3 Nyquist grafieken van symmetrische Li||Li-cellen samengesteld met GCE-x elektrolyten
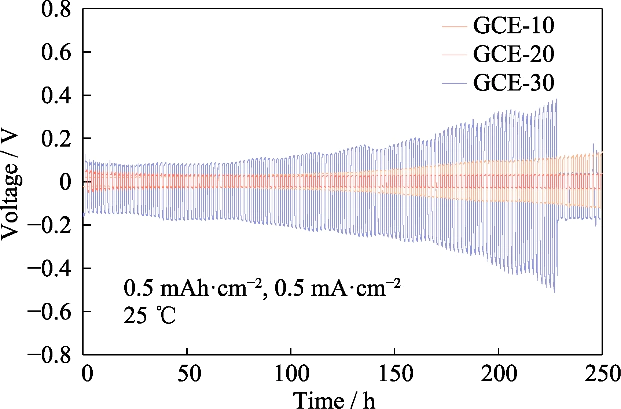
Afb. S4 Voltage-tijdprofielen van symmetrische Li||Li-cellen samengesteld met GCE-x elektrolyten
Afb. S5 XPS-spectra van metalen Li-anode in symmetrische Li||Li-cellen
(a, d) C1s, (b, e) O1s, (c, f) F1s XPS-spectra van metalen Li-anode met (a-c) LE en (d-f) GCE-20
[1] GOODENOUGH J B, KIM Y.
Uitdagingen voor oplaadbare Li-batterijen
Chemie van Materialen, 2010, 22(3):587.
[2] ZHAO J, LIAO L, SHI F, et al.
Oppervlaktefluorering van reactieve batterijanodematerialen voor verbeterde stabiliteit
Dagboek van de American Chemical Society, 2017, 139(33):11550.
[3] TARASCON J M, ARMAND M.
Problemen en uitdagingen gericht op oplaadbare lithiumbatterijen
Natuur, 2001, 414(6861):359.
[4] ZHI J, YAZDI A Z, VALAPPIL G, et al.
Kunstmatige vaste stof elektrolyt-interfase voor waterige lithium-energieopslagsystemen
Wetenschappelijke vooruitgang, 2017, 3(9):e1701010.
[5] JUN K, SUN Y, XIAO Y, en al.
Lithium superionisch geleiders met hoekdeelframes
Natuurmaterialen, 2022, 21: 924.
[6] LIU J, BAO Z, CUI Y, et al.
Wegen voor praktische lithium-metaalbatterijen met hoge energie en lange levensduur
Natuurenergie, 2019, 4(3):180.
[7] DUNN B, KAMATH H, TARASCON J M.
Elektrische energie opslag voor het net: een batterij van keuzes
Wetenschap, 2011, 334(6058):928.
[8] MAUGER A, JULIEN C M, PAOLELLA A, et al.
Beter bouwen batterijen in vaste toestand: een recensie
Materialen, 2019, 12(23):3892.
[9] MANTHIRAM A, YU X, WANG S.
Lithiumbatterij chemie mogelijk gemaakt door elektrolyten in vaste toestand
Natuurrecensies Materialen, 2017, 2(4):16103.
[10] ZHOU D, SHANMUKARAJ D, TKACHEVA A, en al.
Polymeerelektrolyten voor lithiumbatterijen: vooruitgang en vooruitzichten
Chem, 2019, 5(9):2326.
[11] TAN S J, YUE J, TIAN Y F, et al.
In-situ vlamvertragend fosfaat inkapselen in een robuuste polymeermatrix voor veilige en stabiele quasi-solid-state lithium-metaalbatterijen
Energieopslag Materialen, 2021, 39: 186.
[12] ZHAO Q, LIU X, STALIN S, en al.
Polymeer in vaste toestand elektrolyten met ingebouwd snel grensvlaktransport voor secundair lithium batterijen
Natuurenergie, 2019, 4(5):365.
[13] ZHOU Z, FENG Y, WANG J, en al.
Een robuust, zeer rekbare ionengeleidende huid voor stabiele lithium-metaalbatterijen
Chemische technologie Tijdschrift, 2020, 396: 125254.
[14] WILKEN S, TRESKOW M, SCHEERS J, en al.
Eerste stadia van thermische ontleding van op LiPF6 gebaseerde elektrolyten van lithiumionbatterijen door gedetailleerde Raman en NMR spectroscopie
RSC-vooruitgang, 2013, 3(37):16359.
[15] LIU F Q, WANG WP, YIN Y X, et al.
Traditioneel upgraden vloeibare elektrolyt via in situ gelering voor toekomstig lithium metalen batterijen
Wetenschappelijke vooruitgang, 2018, 4(10):eaat5383.
[16] XU C, SUN B, GUSTAFSSON T, en al.
Interfacelaag vorming in lithiumbatterijen met vaste polymeerelektrolyten: een XPS-onderzoek
Journaal met materialen Chemie A, 2014, 2(20):7256.
[17] WEI Z, CHEN S, WANG J, en al.
Superieure lithium-ion geleiding van polymeerelektrolyt met kamachtige structuur via oplosmiddelvrij copolymerisatie voor bipolaire lithiumbatterij in vaste toestand
Journaal met materialen Chemie A, 2018, 6(27):13438.
[18] DINOTO V, LAVINA S, GIFFIN GA, et al.
Polymeerelektrolyten: heden, verleden en toekomst
Electrochimica Acta, 2011, 57(15):4.
[19] XUE Z, HE D, XIE X.
Poly(ethyleen oxide)-gebaseerde elektrolyten voor lithium-ionbatterijen
Journaal met materialen Chemie A, 2015, 3(38):19218.
[20] MINDEMARK J, LACEY M J, BOWDEN T, et al.
Voorbij PEO-alternatieve gastheermaterialen voor Li+-geleidende vaste polymeerelektrolyten
Vooruitgang in polymeer Wetenschap, 2018, 81: 114.
[21] ARAVINDAN V, GNANARAJ J, MADHAVI S, en al.
Lithium-ion geleidende elektrolytzouten voor lithiumbatterijen
Chemistry-A European Journal, 2011, 17(51):14326.
[22] XU K.
Elektrolyten en interfasen in Li-ion-batterijen en verder
Chemische recensies, 2014, 114(23):11503.
[23] YANG H, ZHUANG G V, ROSS JR P N.
Thermische stabiliteit van LiPF6-zout en Li-ionbatterij elektrolyten die LiPF6 bevatten
Journaal van de macht Bronnen, 2006, 161(1):573.
[24] LI Q, LIU G, CHENG H, et al.
Lage temperatuur elektrolytontwerp voor lithium-ionbatterijen: vooruitzicht en uitdagingen
Chemie: een Europeaan Tijdschrift, 2021, 27(64):15842.
[25] JIAO S, REN X, CAO R, et al.
Stabiel fietsen van hoogspanningslithiummetaalbatterijen in etherelektrolyten
Natuurenergie, 2018, 3(9):739.
[26] LIU Y, YU P, SUN Q, en al.
Voorspelde operando polymerisatie aan de lithiumanode via boorinsertie
ACS Energiebrieven, 2021, 6(6):2320.
[27] CAO W, LU J, ZHOU K, et al.
Organisch-anorganisch composiet SEI voor een stabiele Li-metaalanode door in-situ polymerisatie
Nano-energie, 2022, 95: 106983.
[28] CHENG S, SMITH D M, LI C Y.
Hoe werkt het op nanoschaal? kristallijne structuur beïnvloedt ionentransport in vaste polymeerelektrolyten
Macromoleculen, 2014, 47(12):3978.
[29] JOHANSSON P.
Eerste principes modellering van amorfe polymeerelektrolyten: Li+-PEO-, Li+-PEI- en Li+-PES-complexen
Polymeer, 2001, 42(9):4367.
[30] SUN B, MINDEMARK J, EDSTRÃM K, et al.
Op basis van polycarbonaat vaste polymeerelektrolyten voor Li-ion-batterijen
Solid State Ionics, 2014, 262: 738.
[31] SILVA M M, BARROS S C, SMITH M J, et al.
Karakterisering van vaste polymeerelektrolyten op basis van poly(trimethyleencarbonaat) en lithium tetrafluorboraat
Electrochimica Acta, 2004, 49(12): 1887.
[32] BARBOSA P, RODRIGUES L, SILVA M M, et al.
Karakterisering van pTMCnLiPF6 vaste polymeerelektrolyten
Solid State Ionics, 2011, 193(1):39.